有很多时候,很多的文章发着高分的期刊,但是下载下来一看,似乎也并没有什么出奇之处,让人觉得这样的文章给自己自己也能做。今天我们就来分享这样一篇文章,让我们来看看它到底是怎样的奥妙。

这篇名为"Loss of PLK2 induces acquired resistance to temozolomide in GBM via activation of notch signaling"的文章发表于Journal of Experimental & Clinical Cancer Research杂志。
原文链接:10.1186/s13046-020-01750-4
研究背景
1. 丝氨酸/苏氨酸蛋白激酶极化激酶2(PLK2)是一个关键的调节因子,它参与中心体复制、G1/S期过渡和突触可塑性。然而,PLK2在胶质母细胞瘤(Glioblastoma multiforme,GBM)的发生和化疗耐药性中的潜在功能仍然不清楚。
2. Notch信号通路是最为保守的信号通路之一,由于Notch信号通路对于GBM的多种恶性疾病至关重要,因此探究Notch信号通路在GBM中的潜在分子机制至关重要。
研究过程与结果
1. PLK2在TMZ耐药性的GBM中显著下调
作者为了研究TMZ耐药性的GBM中不同编码激酶的基因表达,使用先前发表的GEO数据库进行了层次双向聚类,发现PLK2是TMZ耐药性组中最显著受抑制的编码激酶基因之一(图1A)。此外,作者分析了GBM组织与非肿瘤组织的差异表达基因。结果显示,在两个数据库中PLK2的表达一致下调(图1B, C)。
如图1D所示,Venn图中显示了三个数据库中重叠的下调基因。总共有4个基因与TMZ耐药性和GBM均呈负相关,包括PRKACB、DGKZ、PLK2和RPS6KA5。综上所述,PLK2在与GBM和TMZ耐药性相关的不同表达中显示出显著差异。因此,我们在本研究中选择了PLK2作为候选基因。
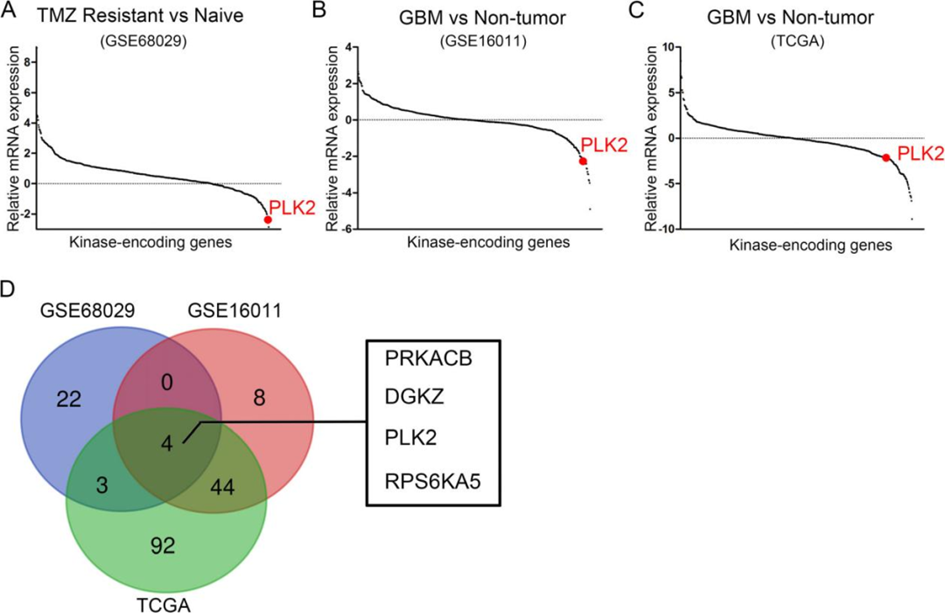
图1. PLK2在TMZ耐药性的GBM中显著下调
2. PLK2表达降低与胶质瘤患者预后不良密切相关
为了更深入了解PLK2在GBM中的临床相关性,作者使用在线服务器GEPIA分析了TCGA GBM数据库。如图2A所示,与非肿瘤组织相比,PLK2在GBM中显著下调。
此外,作者研究了PLK2在包括星形胶质瘤、胶质母细胞瘤和寡突胶质瘤在内的不同病理亚型的表达模式。显然,与非肿瘤组织中PLK2的高表达相比,其他类型的胶质瘤的PLK2的表达被显著抑制(图2B)。此外,与非肿瘤组织相比,GBM的4个分子亚型,包括经典型(CL)、间充质型(MES)、神经型(Neural)和促神经型(PN),PLK2的表达明显受到抑制(图2C)。这些数据表明,PLK2的缺失是GBM的重要生物标志物,这促使作者更深入地研究PLK2和GBM的相关性。
作者另外进行了免疫组化染色,选择临床患者样本中测定PLK2的表达。结果显示,PLK2主要在初期胶质瘤和非肿瘤样本的胞质细胞膜中表达,然而,在GBM样本中,染色显著较低。KM生存分析显示,与PLK2表达较高的患者相比,PLK2表达较低的胶质瘤患者的总体生存期较短(图2D)。为了验证这些发现,分析了Rembrandt数据库中的676名患者的样本,观察到类似的结果(图2E)。
尽管接受了术后放疗或TMZ化疗,PLK2低表达患者的总体生存期仍然没有较好的改善。总的来说,这些数据表明,PLK2的沉默可能会导致疾病的恶化。
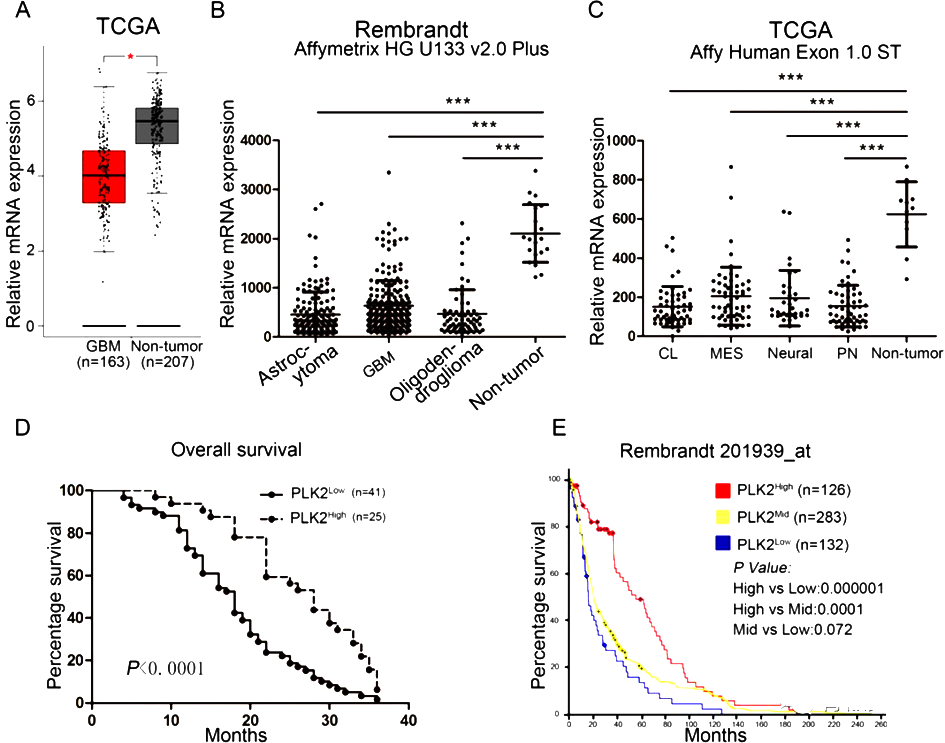
图2. PLK2表达降低后相关表达分析图
3. PLK2过表达降低GBM细胞的恶性程度
为进一步研究PLK2的功能,通过慢病毒转导将外源PLK2引入U87和U251细胞系,通过免疫荧光成像来测定转导效率(图3A)。qRT-PCR(图3B)和Western blot分析(图3C)显示,与阴性对照相比,PLK2过表达的慢病毒转导的U87和U251细胞中PLK2 mRNA的表达量显著增加。
为了探究PLK2过表达对GBM细胞肿瘤恶性程度的影响,进行了体外细胞增殖实验和集落形成实验。结果表明,PLK2过表达影响了细胞生长和自我复制能力(图3D-F)。
此外,PLK2过表达的胶质瘤细胞的凋亡率显著增加(图3G)。根据细胞迁移实验,PLK2过表达显著降低了U87和U251细胞系的迁移能力(图3H和I)。此外,建立了颅内异种移植小鼠模型以研究PLK2对肿瘤的影响。结果显示,大多数移植PLK2过表达U87细胞系的小鼠未形成肿瘤(图3J)。KM分析显示,上调的PLK2抑制了体内肿瘤生长,延长了异种移植小鼠的生存时间(图3K)。总的来说,这些数据表明,PLK2过表达降低了GBM细胞的恶性程度,包括体外和体内的增殖、迁移、自我更新和肿瘤的发生。
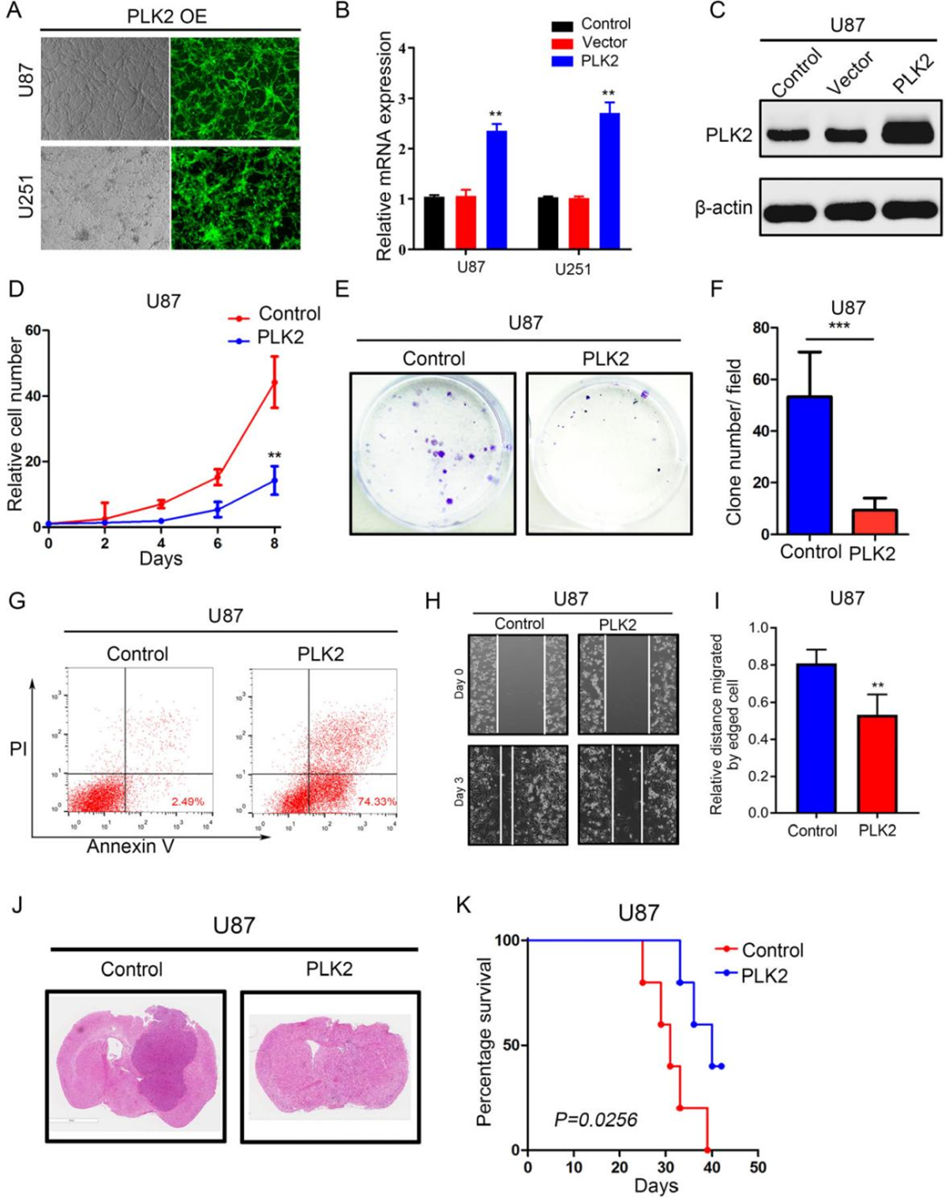
图3. PLK2过表达降低GBM细胞的恶性程度
4. 上调的PLK2促进了GBM对化疗的敏感性
为进一步研究PLK2与TMZ耐药性之间的相关性,先进行了TMZ耐药的U87和U251细胞系构建,然后进行细胞活力实验。
如图4A所示,相比未经处理的原始细胞系,耐药细胞系对TMZ治疗表现出较低的敏感性。且U87和U251耐药细胞系中PLK2表达下调(图4B, C)。随后,将TMZ耐药细胞系过表达PLK2,qRT-PCR分析显示,与对照细胞相比,PLK2 mRNA表达在PLK2过表达的U87和U251细胞中显著增加(图4D)。同样,PLK2的蛋白水平也过表达上调(图4E)。随后进行了体外细胞增殖实验以研究PLK2过表达对获得性TMZ耐药性的影响。结果显示,增强的PLK2表达显著减弱了耐药的U87和U251细胞系的增殖(图4F)。
此外,流式细胞仪实验用于研究U87和U251耐药细胞系的凋亡情况,在TMZ处理下,PLK2过表达显著提高了耐药性胶质瘤细胞系的凋亡率(图4G)。此外,同样使用TMZ耐药的U87和U251细胞系构建了体内异种移植小鼠模型,结果显示,与对照组相比,移植了PLK2过表达的U87耐药细胞系的小鼠对TMZ治疗变得更为敏感。同样KM分析显示,在接受TMZ治疗时,PLK2过表达小鼠组的生存时间在单LK2过表达组的基础上延长(图4H)。
综上所述,这些发现表明,PLK2的确实促使GBM的TMZ耐药性增强,而上调PLK2表达增强了GBM对TMZ的敏感性。
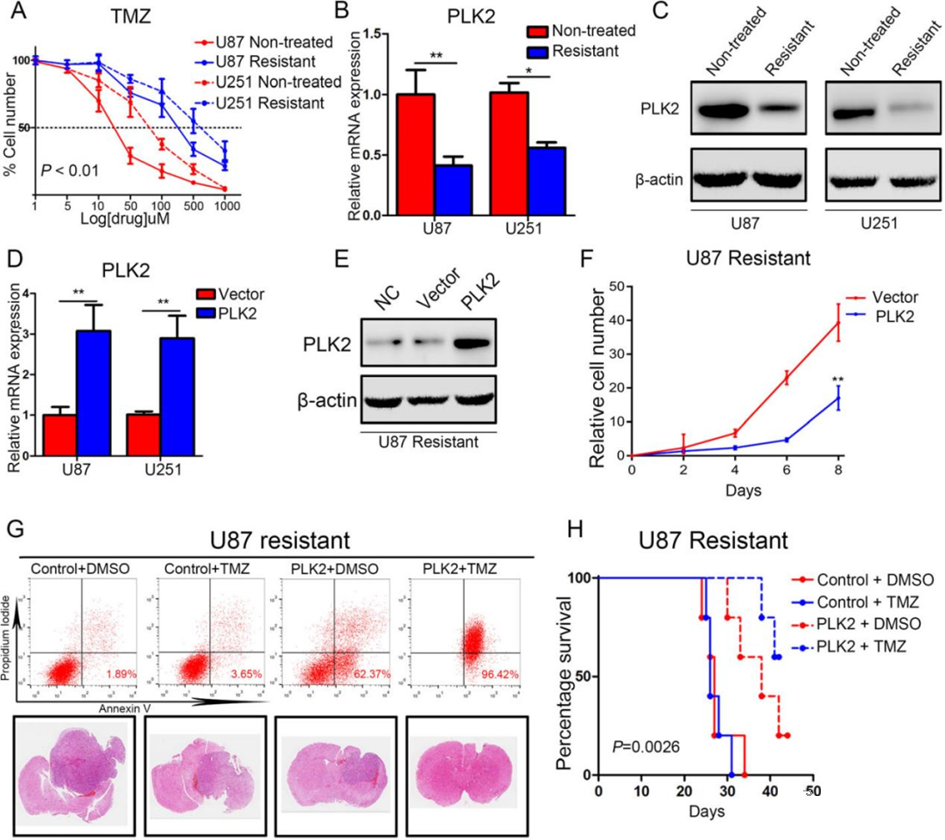
图4.上调的PLK2促进了GBM对化疗的敏感性
5. PLK2的缺失激活notch信号增强了GBM对TMZ的抗性
正如之前所证明的,PLK2作为一个抑癌基因,减弱了GBM的化疗耐药性,为此,使用TCGA数据库和GSE16011数据库进行了生物信息学分析以深入研究由PLK2调节的潜在信号通路是至关重要的。
转录组文件分别根据PLK2的表达分成了两组。双向聚类分析显示了PLK2high和PLK2low GBM中的显著基因特征(图5A, B)。
然后进行了GSEA富集分析,以找出与PLK2负相关的信号通路。如图5C-F所示,Notch信号通路是唯一在两个数据库中的PLK2low组中同时富集的信号通路。因此,选择Notch信号通路作为PLK2的候选下游信号通路。
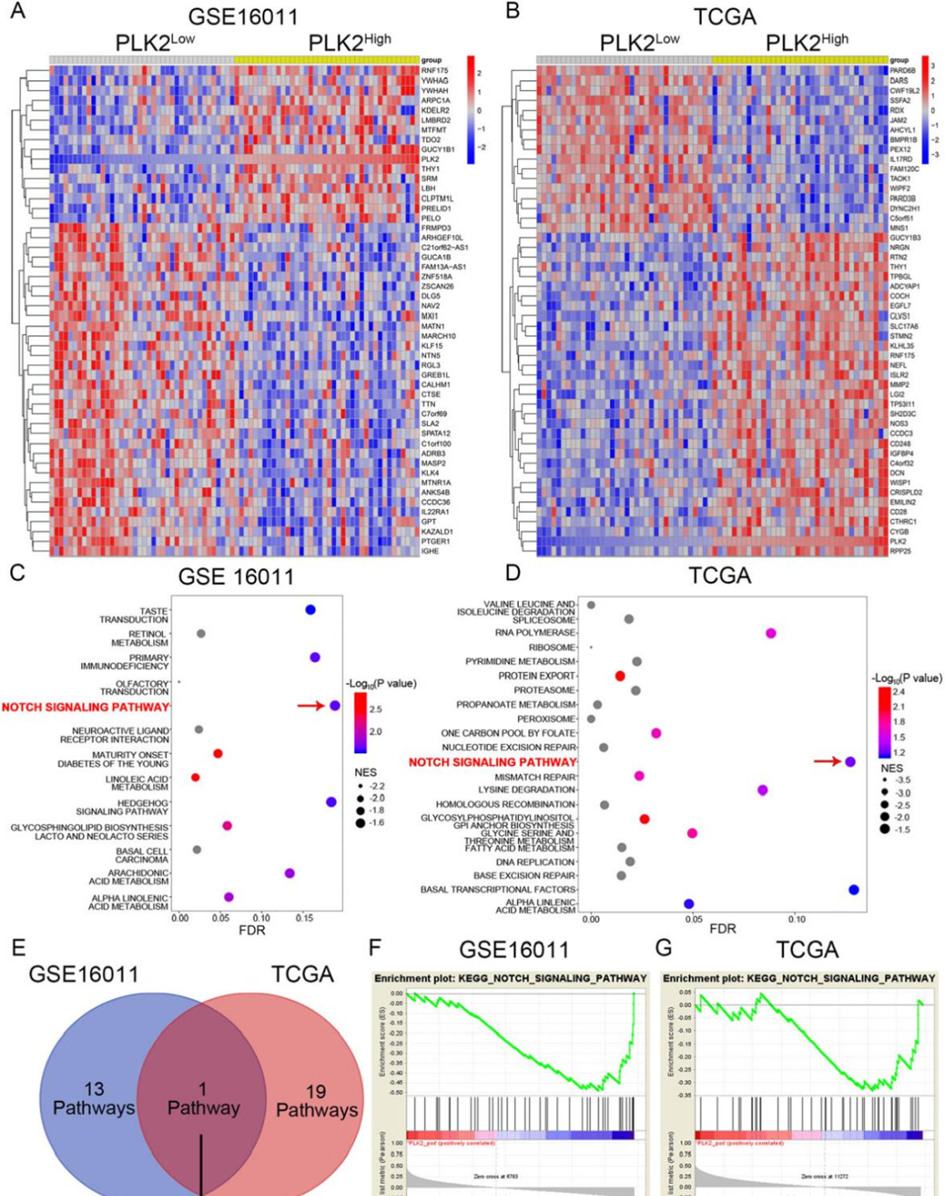
图5. PLK2的缺失激活notch信号增强了GBM对TMZ的抗性
6. PLK2的缺失激活notch信号增强了GBM对TMZ的抗性
为了进一步确认PLK2和Notch通路之间潜在机制的结果,进行了qRT-PCR和Western blot实验。结果显示,PLK2的过表达显著降低了Notch信号通路的下游靶标在转录组和翻译水平上,包括HES1、cMYC、p21、Cyclin D3(图6A, B)。反之,PLK2的敲低显著增强了Notch信号通路的这些响应靶标的表达(图6C)。
为进一步探究结果的可靠性,作者在PLK2过表达的U87细胞中进一步过表达HES1(图6D)。值得注意的是,PLK2过表达会抑制细胞生长(图6E)、集落形成(图6F, G)和迁移能力(图6H),但在HES1同样过表达时抑制部分恢复,表明PLK2可能通过转录调控HES1,进一步通过沉默Notch信号通路降低GBM细胞的恶性程度。
为了进一步阐明PLK2对Notch信号通路激活的影响,用Western blot测定U87细胞系中活化的Notch1和Notch2的表达。结果表明,在PLK2的外源过表达后,notch1的表达明显降低,而notch2的表达没有明显受到影响(图6I)。
同样,PLK2的抑制增加了GBM中Notch1蛋白的表达,表明Notch1是PLK2可以通过其来失活Notch通路的重要调控因子(图6J)。为了验证这一点,使用MG132进行了蛋白稳定性实验,用于阻断蛋白质降解,使用PLK2过表达的U87细胞进行了MG132实验。结果显示,在U87细胞中,PLK2过表达后,Notch1的蛋白稳定性明显降低(图6K)。与这些结果一致,与对照组相比,在PLK2过表达的样本中,泛素化的Notch水平明显增加(图6L),表明PLK2的丧失通过抑制Notch1蛋白的降解来稳定Notch1,从而激活了Notch信号通路,最终导致获得性TMZ耐药和肿瘤复发。
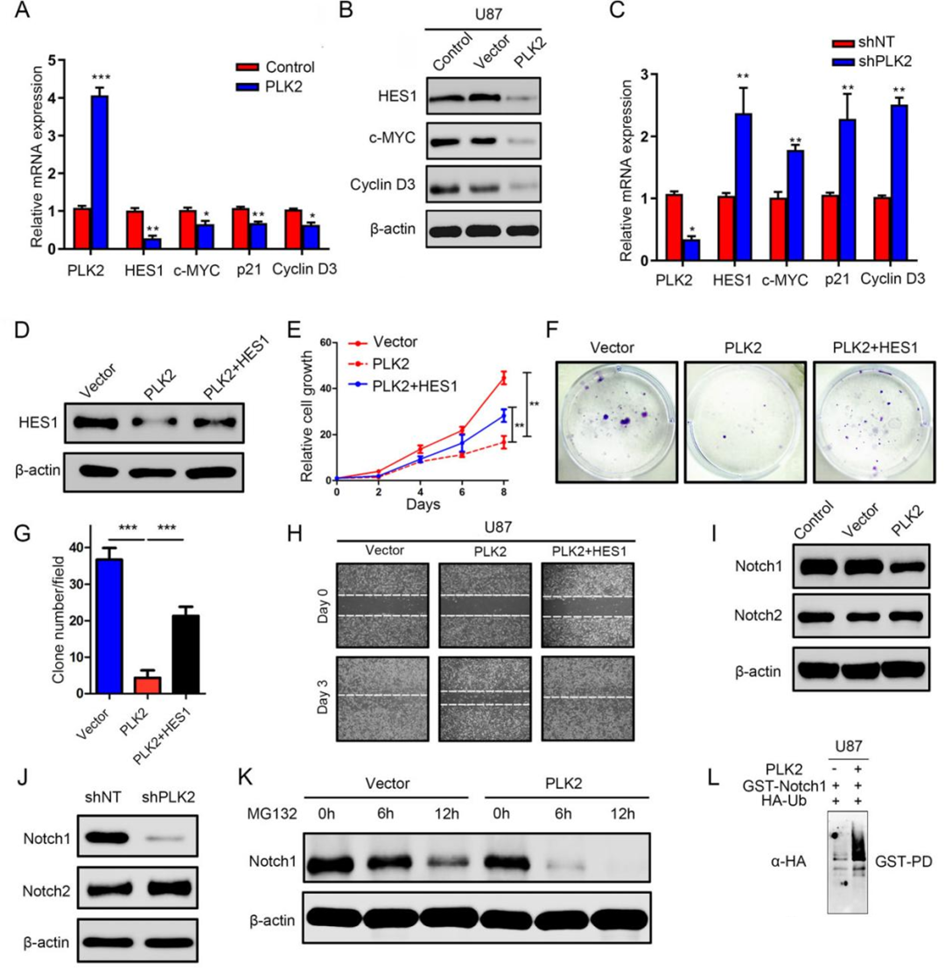
图6.PLK2的缺失激活notch信号增强了GBM对TMZ的抗性
研究总结
在这项研究中,作者发现PLK2在GBM中下调,而PLK2的升高与GBM患者的化疗敏感性和良好的预后呈正相关。此外,PLK2的过表达减弱了GBM细胞的增殖并增强了其对化疗药物的敏感性。证明了PLK2的丧失通过激活Notch信号通路,通过调控HES1的转录和Notch降解诱导了对TMZ的耐药性。总的来说,PLK2-Notch轴可能是TMZ耐药性GBM的预后生物标志物和潜在治疗靶点。













